硫化镍
硫化镍是一种无机化合物,化学式为NiS。它在自然界中以针镍矿的形式存在。硫化鎳在商業上可用作催化劑。
| 硫化镍 | |
|---|---|
 | |
| IUPAC名 Nickel(II) sulfide | |
| 别名 | 一硫化镍 |
| 识别 | |
| CAS号 | 11113-75-0 |
| PubChem | 28094 |
| ChemSpider | 26134 |
| SMILES |
|
| EINECS | 234-349-7 |
| RTECS | QR9705000 |
| 性质 | |
| 化学式 | NiS |
| 90.7584 g·mol⁻¹ | |
| 外观 | 黑色固體 |
| 氣味 | 無味 |
| 密度 | 5.87 g/cm3 |
| 熔点 | 797 °C(1070 K) |
| 沸点 | 1388 °C(1661 K) |
| 溶解性(水) | 難溶 |
| 溶解性 | 溶於硝酸 |
| 磁化率 | +190.0·10−6 cm3/mol |
| 结构 | |
| 晶体结构 | 六方 |
| 危险性 | |
GHS危险性符号 | |
| 主要危害 | 吸入可能致癌 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
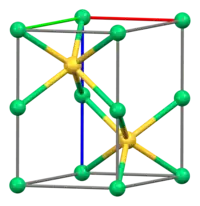
結構
硫化鎳採用砷化鎳結構。在這種結構中,鎳是八面體,硫化物中心位於三棱柱位置。[1]
| 鎳 | 硫 |
|---|---|
 |
 |
| 八面體 | 三方稜柱體 |
硫化镍有兩種同質異形體。α型為六角形晶胞,而β相為菱面體晶胞。α型在379 °C(714 °F)以上的溫度下穩定,在較低溫度下轉變為β型。此相變使體積增加2-4%。[2][3][4]
合成
硫化镍可由传统的镍盐与硫化氢反应的方法制备:[5]
- Ni2+ + H2S → NiS + 2 H+
镍盐溶液和硫化铵溶液反应,也能得到α-NiS,它刚沉淀出来时主要含有非晶态的Ni(SH,OH)2。较低pH下结晶出γ型,较高pH下结晶出β型。[6]
人們還開發了許多其他更受控的方法,包括固態複分解反應(來自NiCl2和Na2S)和镍和硫之間的高溫反應。[7]
反應
硫化鎳最常见的反应是转化为氧化鎳。这种转化包括在空气中加热硫化镍矿石:[8]
- 2 NiS + 3 O2 → 2 NiO + 2 SO2
在碱性溶液中,硫化镍可以将一氧化碳定量地转化为四羰基镍:
- NiS + 4 OH- + 5 CO → Ni(CO)4 + S2− + CO32- + 2 H2O
產生
自然界

針鎳礦晶體
針鎳礦也是一種硫化鎳的礦物形式,分子式為NiS,但由於其形成條件差異,其結構與合成化學計量的NiS不同。它天然存在於低溫熱液系統、碳酸鹽岩的空洞中,也是其他鎳礦物的副產品。[10]
參考資料
- Wells, A.F. (1984) Structural Inorganic Chemistry, Oxford: Clarendon Press. ISBN 0-19-855370-6.
- Bishop, D.W.; Thomas, P.S.; Ray, A.S. . Materials Research Bulletin. 1998, 33 (9): 1303. doi:10.1016/S0025-5408(98)00121-4.
- . Glass on Web. Nov 2012. (原始内容存档于2013-06-12).
- Bonati, Antonio; Pisano, Gabriele; Royer Carfagni, Gianni. . Journal of the American Ceramic Society. 12 October 2018, 102 (5): 2506–2521. S2CID 140055629. doi:10.1111/jace.16106.
- O.Glemser "Nickel Sulfide" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 2. p. 1551.
- 谢高阳 等. 无机化学丛书 第九卷 锰分族 铁系 铂系. 科学出版社, 2011. pp 287. 硫化镍. ISBN 978-7-03-030545-9
- leading reference can be found in: Shabnam Virji, Richard B. Kaner, Bruce H. Weiller "Direct Electrical Measurement of the Conversion of Metal Acetates to Metal Sulfides by Hydrogen Sulfide" Inorg. Chem., 2006, 45 (26), pp 10467–10471.doi:10.1021/ic0607585
- Kerfoot, Derek G. E., , , Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a17_157
- Pradyot Patnaik, Ph.D. Handbook of inorganic chemicals (页面存档备份,存于). McGraw-Hill, 2002. pp 251. COBALT SULFIDES ISBN 0-07-049439-8
- Gamsjager H. C., Bugajski J., Gajda T., Lemire R. J., Preis W. (2005) Chemical Thermodynamics of Nickel, Amsterdam, Elsevier B.V.
- Karlsson, Stefan. . Ceramics - Silikaty. 30 April 2017: 188–201 [16 August 2019]. doi:10.13168/cs.2017.0016
 .
. - Barry, John. . Glass on Web. 12 January 2006 [16 August 2019]. (原始内容存档于2023-04-29).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.