聚脯氨酸螺旋
聚脯氨酸螺旋是由重复的脯氨酸残基构成的一种蛋白质二级结构。[1] 当连续的残基与主链的二面角(φ,ψ)都大约为(-75°, 150°),并且它们的肽键是反式构型时,就会形成左旋的聚脯氨酸II型螺旋(PPII,聚-脯II)。除了脯氨酸以外的其他氨基酸的蛋白质和多肽中也常见这种PPII构象。同样地,当连续的残基与主链的二面角(φ,ψ)都大约为(-75°, 160°)并且它们的肽键是顺式构型时,就会形成更紧密的左旋的聚脯氨酸I型螺旋(PPI,聚-脯I)。在二十种常见的天然氨基酸中,只有脯氨酸的肽键倾向于形成顺式异构体,特别是X-脯肽键;在大部分其他肽键中,空间和电子因素都强烈地倾向于反式异构体。但是,如果将脯氨酸替换为另一种N-取代氨基酸(如甘氨酸甲酯),那么这种肽键也倾向于采用顺式异构体。
聚脯氨酸II型螺旋

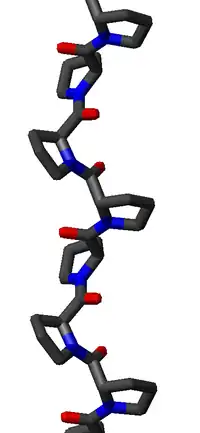
聚-脯II型螺旋结构由大约为(-75°, 150°)的主链二面角(φ,ψ)和反式肽键这两个特征确定。具有反式异构体的多肽螺旋的每个残基的旋转角Ω由下式给出
将聚-脯II型(φ,ψ)二面角代入这个方程,得到Ω = -120°,即PPII型螺旋是一个左手性螺旋(因为Ω是负数),每个转动有三个残基(360°/120° = 3)。每个残基的升高约为3.1 Å。这种结构与主要由脯氨酸、羟脯氨酸和甘氨酸组成的纤维蛋白胶原的结构有点相似。PPII型螺旋被SH3结构域特异性地结合;这种结合对许多蛋白质-蛋白质相互作用甚至对单个蛋白质的结构域之间的相互作用都很重要。
PPII型螺旋相对开放,没有内部氢键,与更常见的α-螺旋、310螺旋、π螺旋和β螺旋等螺旋二级结构不同。酰胺氮和氧原子之间的距离太远(约3.8 Å),而且方向不合适,无法形成氢键。另外,这些原子在脯氨酸中都是H-键受体;由于环状侧链,没有H-键供体。
除了脯氨酸以外的其他氨基酸,它们与主链的二面角(φ,ψ)为(-75°, 150°)的情况在蛋白质中也经常被观察到。[2] Ramachandran图在PPII区域高度聚集,与位于(-135°, 135°)附近的β-折叠区域密集程度相当。例如,PPII主链二面角经常出现在转角中,最常见的是在II型β-转角的第一个残基中。PPII主链二面角的“镜像”角度(75°, -150°)很少见,除非是由无手性的氨基酸甘氨酸组成的聚合物。在聚甘氨酸中,聚-脯II型螺旋的类似物被称为聚-甘II型螺旋。Hypogastrura harveyi的抗冻蛋白等蛋白质由富含甘氨酸的聚-甘II型螺旋束组成。[3] 这种独特的蛋白质,其三维结构已知,[4]具有独特的NMR光谱,并且通过二聚化和28个Cα-H··O=C氢键稳定。PPII型螺旋在跨膜蛋白中不常见,而且这种二级结构在自然条件下不会穿过脂质膜。2018年,德国的研究人员构建并实验观察了由特别设计的人工肽形成的第一个跨膜PPII型螺旋。[5][6]
聚脯氨酸I型螺旋


聚-脯I型螺旋中的肽键为顺式构型,因此PPI型螺旋的结构比PPII型螺旋更密集。它也比PPII构象更罕见,因为酰胺键的顺式异构体能量比反式异构体高。它的典型二面角(-75°, 160°)接近但不完全相同于PPII型螺旋的二面角。然而,PPI型螺旋是一个右手性螺旋,而且更紧密,每个转动大约有3.3个残基(而不是3)。PPI型螺旋每个残基的升高也更小,大约为1.9 Å。同样地,在聚-脯I型螺旋中没有内部氢键,一方面是因为缺少H-键供体原子,另一方面是因为酰胺氮和氧原子距离太远(大约又是3.8 Å)并且方向不正确。
结构性质
传统上,PPII被认为相对刚性,并被用作结构生物学中的“分子尺” ,例如用来校准荧光共振能量转移效率测量。然而,后续的实验和理论研究对这种将聚脯氨酸视为“刚性棒”的观点提出了质疑。[7][8] 使用太赫兹光谱和密度泛函理论计算的进一步研究表明多-脯实际上比最初想象的要灵活得多。[9] PPII和PPI型螺旋之间的转换很慢,因为顺反异构化的活化能很高(Ea ≈ 20 kcal/mol);然而,这种转换可以由称为脯氨酸异构酶或PPIase的异构酶催化。PPII和PPI型螺旋之间的转换涉及整个肽链沿着顺反肽键异构化。基于离子迁移率谱学的研究揭示了这一过程中存在一组确定的中间体。[10]
参考文献
- Adzhubei, Alexei A.; Sternberg, Michael J.E.; Makarov, Alexander A. . Journal of Molecular Biology. 2013, 425 (12): 2100–2132. ISSN 0022-2836. PMID 23507311. doi:10.1016/j.jmb.2013.03.018.
- Adzhubei, Alexei A.; Sternberg, Michael J.E. . Journal of Molecular Biology. 1993, 229 (2): 472–493. ISSN 0022-2836. PMID 8429558. doi:10.1006/jmbi.1993.1047.
- Davies, Peter L.; Graham, Laurie A. . Science. 2005-10-21, 310 (5747): 461. ISSN 0036-8075. PMID 16239469. doi:10.1126/science.1115145 (英语).
- Pentelute, Brad L.; Gates, Zachary P.; Tereshko, Valentina; Dashnau, Jennifer L.; Vanderkooi, Jane M.; Kossiakoff, Anthony A.; Kent, Stephen B. H. . Journal of the American Chemical Society. 2008-07-01, 130 (30): 9695–9701. ISSN 0002-7863. PMC 2719301
 . PMID 18598029. doi:10.1021/ja8013538.
. PMID 18598029. doi:10.1021/ja8013538. - Kubyshkin, Vladimir; Grage, Stephan L.; Ulrich, Anne S.; Budisa, Nediljko. . The Journal of Physical Chemistry Letters. 2018, 9 (9): 2170–2174. PMID 29638132. doi:10.1021/acs.jpclett.8b00829 (英语).
- Kubyshkin, Vladimir; Grage, Stephan L.; Ulrich, Anne S.; Budisa, Nediljko. . Physical Chemistry Chemical Physics. 2019, 21 (40): 22396–22408. Bibcode:2019PCCP…2122396K 请检查
|bibcode=值 (帮助). PMID 31577299. doi:10.1039/c9cp02996f (英语).
(英语). - S. Doose, H. Neuweiler, H. Barsch, and M. Sauer, Proc. Natl. Acad. Sci. USA. 104, 17400 (2007)
- M. Moradi, V. Babin, C. Roland, T. A. Darden, and C. Sagui, Proc. Natl. Acad. Sci. USA. 106, 20746 (2009)
- M. T. Ruggiero, J. Sibik, J. A. Zeitler, and T. M. Korter, Agnew. Chemie. Int. Ed. 55, 6877 (2016)
- El-Baba, Tarick J.; Fuller, Daniel R.; hales, David A.; Russel, David H.; Clemmer, David E. . Journal of the American Society for Mass Spectrometry. 2019, 30 (1): 77–84. Bibcode:2019JASMS…30…77E 请检查
|bibcode=值 (帮助). PMC 6503664 . PMID 30069641. doi:10.1007/s13361-018-2034-7 (英语).
. PMID 30069641. doi:10.1007/s13361-018-2034-7 (英语).