突觸融合蛋白
突觸融合蛋白(英語:syntaxin)是膜嵌入蛋白Q-SNARE的一個家族,參與胞吐作用。[2]
| Syntaxin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Syntaxin-1A N端結構域的結構[1] | |||||||||
| 鑑定 | |||||||||
| 標誌 | Syntaxin | ||||||||
| Pfam | PF00804(旧版) | ||||||||
| InterPro | IPR006011 | ||||||||
| SMART | SM00503 | ||||||||
| SCOP | 1br0 / SUPFAM | ||||||||
| OPM家族 | 197 | ||||||||
| OPM蛋白 | 2xhe | ||||||||
| 膜蛋白數據庫 | 349 | ||||||||
| |||||||||
功能
活體外的syntaxin本身就足以驅動含有v-SNARE突觸囊泡的自發性非鈣依賴性融合。 [5]
最近有些爭議的電流式分析數據表明,Syntaxin-1A 的穿膜結構域可能構成胞吐作用中融合孔(fusion pore)的一部分。 [6]
結合
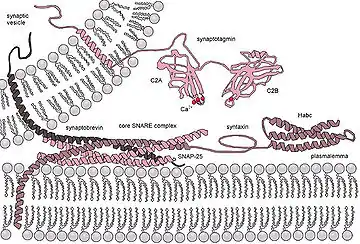
Syntaxin以鈣依賴性結合突觸結合蛋白(synaptotagmin),並透過C 端的H3結構域與電壓閘控型的鈣離子和鉀離子通道交互作用。直接的Syntaxin-通道交互作用是一個適合的分子機制,用於在突觸前軸突終紐去極化時,融合機械(fusion machinery)與鈣離子輸入通道的接近。
已知 Sec1/Munc18 蛋白家族會與Syntaxin結合並調節Syntaxin機械。 Munc18-1 透過兩個不同的位點與 Syntaxin-1A 結合,這兩個位點被稱為N端結合和“關閉”構形,後者包含了中心的Habc結構域和SNARE 核心結構域。 Munc18-1結合到 Syntaxin-1的N端被認為會促進 Syntaxin-1與另一個SNARE 的相互作用,而結合到 Syntaxin-1的“關閉”構形被認為是抑制性的。
最近公布的數據顯示,被選擇性剪切、缺乏穿膜結構域的Syntaxin-1B(STX1B)位於細胞核中。[7]
基因
編碼Syntaxin的人類基因包括:
- STX1A, STX1B, STX2, STX3, STX4, STX5, STX6, STX7, STX8 ,
- STX10 、 STX11 、 STX12 、 STX16 、 STX17 、 STX18 、 STX19
參考文獻
- Fernandez I, Ubach J, Dulubova I, Zhang X, Südhof TC, Rizo J. . Cell. Sep 1998, 94 (6): 841–9. PMID 9753330. doi:10.1016/S0092-8674(00)81742-0
 .
. - Bennett MK, García-Arrarás JE, Elferink LA, Peterson K, Fleming AM, Hazuka CD, Scheller RH. . Cell. Sep 1993, 74 (5): 863–73. PMID 7690687. doi:10.1016/0092-8674(93)90466-4.
- Lam AD, Tryoen-Toth P, Tsai B, Vitale N, Stuenkel EL. . Molecular Biology of the Cell. 2008, 19 (2): 485–97. PMC 2230580
 . PMID 18003982. doi:10.1091/mbc.E07-02-0148.
. PMID 18003982. doi:10.1091/mbc.E07-02-0148. - Georgiev DD, Glazebrook JF. Lyshevski SE , 编. . Nano and Microengineering Series. CRC Press. 2007: 17–1–17–41. ISBN 978-0-8493-8528-5.
- Woodbury DJ, Rognlien K. . Cell Biology International. 2000, 24 (11): 809–18. PMID 11067766. doi:10.1006/cbir.2000.0631.
- Han X, Wang CT, Bai J, Chapman ER, Jackson MB. . Science. Apr 2004, 304 (5668): 289–92. PMID 15016962. doi:10.1126/science.1095801.
- Pereira S, Massacrier A, Roll P, Vérine A, Etienne-Grimaldi MC, Poitelon Y, Robaglia-Schlupp A, Jamali S, Roeckel-Trevisiol N, Royer B, Pontarotti P, Lévêque C, Seagar M, Lévy N, Cau P, Szepetowski P. . Gene. Nov 2008, 423 (2): 160–71. PMID 18691641. doi:10.1016/j.gene.2008.07.010.
外部鏈結
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.