依那西普
依那西普(英語:),目前有以Enbrel(恩博) 等商品名稱銷售,是種生物製藥,有腫瘤壞死因子抑制劑作用,可干擾腫瘤壞死因子(TNF,一種可溶性促炎細胞因子,舊稱腫瘤壞死因子-α(TNF-α))來治療自體免疫性疾病,經美國食品藥物管理局 (FDA) 批准用於治療類風濕性關節炎、幼年特發性關節炎和乾癬性關節炎、乾癬和強直性脊柱炎。腫瘤壞死因子是造成許多器官系統發炎(免疫)反應的"主調節因子"。自體免疫性疾病是由個體本身過度活躍的免疫反應所引起。依那西普可透過抑制TNF而達到治療的目的。[13]]
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Enbrel(恩博) |
| 生物相似藥 | Etanercept-szzs, Etanercept-ykro, Benepali, Erelzi, Etacept, Etera,[1] Eticovo, Lifmior, Nepexto,[2] Rymti[3] |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a602013 |
| 核准狀況 |
|
| 懷孕分級 | |
| 给药途径 | 皮下注射 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 藥物動力學數據 | |
| 生物利用度 | 58–76% (SC,口服生物利用率) |
| 生物半衰期 | 70–132小時 |
| 识别 | |
| CAS号 | 185243-69-0 |
| PubChem SID | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.224.383 |
| 化学 | |
| 化学式 | C2224H3475N621O698S36 |
| 摩尔质量 | 51,235.07 g·mol−1 |
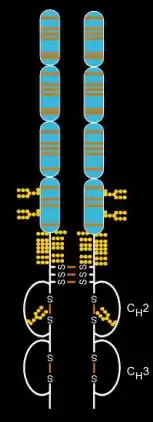
依那西普是種由重組DNA產生的融合蛋白,將TNF受體融合到免疫球蛋白G1 (IgG1)抗體的恆定端。開發人員首先將編碼人類可溶性TNF受體2(CD120)基因的DNA序列分離,CD120是一種可與腫瘤壞死因子結合的受體。他們接著分離出編碼人類免疫球蛋白G1Fc端基因的DNA序列。第三個步驟是他們將TNF受體2的DNA與IgG1 Fc的DNA連接。他們最後表達(轉錄)連接的DNA,以產生一種蛋白質,此蛋白質可將TNF受體2的蛋白質與IgG1 Fc的蛋白質連接。[14]
這種原型融合蛋白是由在美國達拉斯德克薩斯大學西南醫學中心擔任學術研究員的布魯斯·比尤特勒及其同事在1990年代初首次合成,並被證明是種高度活躍且異常穩定的活體內TNF抑制劑。[15][16]
這群研究人員將其發現申請專利,[17]並將所有使用權利出售給一家名為Immunex的公司(一家位於西雅圖的生物技術公司),而Immunex於2002年被安進製藥公司收購。[18]
依那西普是種大型分子,分子重量為150道爾頓(kDa),可與TNF結合,而降低其在人類和其他動物中發生過度發炎的作用,包括自體免疫性疾病,如強直性脊柱炎、[19]幼年特發性關節炎、乾癬、乾癬性關節炎、類風濕性關節炎,以及由過量TNF所介導的各種不同疾病。這種藥物已被列入世界衛生組織基本藥物標準清單中。[20]
醫療用途
在美國,依那西普適用的症狀有:
- 中度至重度類風濕性關節炎 (RA)(1998年11月)[12][21]
- 中度至重度多關節性幼年特發性關節炎(1999年5月)[12][22]
- 乾癬性關節炎(2002年1月)[12][23]
- 強直性脊柱炎 (AS)(2003年7月)[12][24][25]
- 中度至重度乾癬(2004年4月)[12][26]
在歐盟,依那西普適用的症狀有:
不良影響
FDA因為該藥物引起一些嚴重的感染,而曾在2008年5月2日對依那西普發出黑框警告。[31]根據報導,使用依那西普會導致嚴重感染和敗血症(包括潛伏性結核和B型肝炎感染復發),甚至是死亡。[12][32]
發生注射部位反應(例如發紅和疼痛)的案例很常見,比率約為11.4%。[33]
作用機轉
依那西普可降低天然生成TNF的作用,因此是種TNF抑制劑(一種可與TNF結合的誘餌受體)。[34]
TNF是種由淋巴球和巨噬細胞(兩種均為白血球中的成分)產生的細胞激素,可透過吸引額外的白血球到發炎部位,以及透過引發和放大發炎的額外分子機制來介導免疫反應。依那西普能抑制TNF作用而將發炎反應減少,此對於治療自體免疫性疾病特別有用。
TNF受體有兩種:一種嵌入白血球中,透過釋放其他細胞激素對TNF作出反應,另一種是可溶性TNF受體,用於導致TNF失去活性並減弱免疫反應。此外,幾乎所有有核細胞的表面都有TNF受體(無核的紅血球表面不含TNF受體)。依那西普可模仿天然存在的可溶性TNF受體所具的抑制作用。但依那西普不同之處是其為一種融合蛋白,而非單純的TNF受體,因此在血液中的半衰期可大幅延長,有較深入且時間較長的作用。比天然存在的可溶性TNF受體有更持久的生物效應。[35]
結構
依那西普由兩種天然存在的可溶性人類75千道爾頓TNF受體與IgG1 Fc部分連接而成。[36]其作用是人工設計的二聚體融合蛋白。[36]依那西普是一種複雜分子,含有6個N-聚醣、最多14個O-聚醣和29個二硫化物橋結構。[37][38][39]
歷史
第一個與依那西普相關的專利由Immunex於1989年9月5日提交。[40]這種原型融合蛋白是由當時在美國達拉斯德克薩斯大學西南醫學中心擔任學術研究員的布魯斯·比尤特勒及其同事在1990年代初首次合成,並獲得專利,而於1995年將所有使用權利出售給Immunex。[41]於麻省總醫院服務的研究人員Brian Seed所發現的另一融合蛋白質技術也取得專利,並於於1997年將其授權給Immmunex。[42]
依那西普於1998年11月在美國獲准作醫療用途。[12][43]
此藥物於2000年2月在歐盟獲准使用。[7]
社會與文化
經濟學
依那西普於美國的零售價隨著時間演進而持續上漲。 患者於2008年支付的費用為每月1,500美元(即每年18,000美元)。[44]到2011年,費用已超過每年20,000美元。[45][46]一家英國倫敦的醫療保險公司 - 國際健康計畫聯合會 (International Federation of Health Plans,簡稱IFHP) 於2013年所做的調查發現,美國患者於依那西普的平均費用為每月2,225美元,即每年26,700美元。[47]IFHP報告中顯示美國各種健康計劃的收費價格差異很大,患者中從第25個百分位数的1,946美元到第95個百分位数的4,006美元不等。[47]
在美國,依那西普的售價比其他國家為貴。[47]截至2013年,接受調查的國家的平均每月費用從瑞士的1,017美元到加拿大的1,646美元不等,而美國的平均每月費用為2,225美元。[47]
安進在美國和加拿大境內銷售依那西普,而輝瑞在兩國以外的國家和地區銷售該藥物。[45]於2010年,美國和加拿大的銷售額為35億美元,[45]同一年度在前述兩國以外的銷售額則為33億美元。[48]
專利
依那西普的專利原定於2012年10月23日到期,[49]但該藥物在美國因取得第二項專利,又取得16年的獨佔權。[50]
在第二項專利到期之前,依那西普的通用名藥物(又稱學名藥)似乎不太可能出現。依那西普是生物製劑,與化學製劑適用的法律不同,許多國家不允許生產生物製劑的學名藥。然而歐盟,以及美國,由美國國會通過,由巴拉克·歐巴馬總統簽署的《2009年生物製品價格競爭和創新法案(Biologics Price Competition and Innovation Act of 2009)》)已制定批准生物製藥學名藥(生物相似藥)的措施,但要求參與者須"實施強制臨床測試和定期審查"。[51]
印度大型製藥公司西普拉有限公司於2013年4月宣布在印度推出首款依那西普生物相似藥(與中國上海中信國健藥業有限公司(Shanghai CP Guojian Pharmaceutical Co. Ltd.)合作生產),商品名為Etacept,用於治療風濕性疾病。[52][53]
參考文獻
- . Therapeutic Goods Administration (TGA). [2021-06-12].
- . European Medicines Agency. 24 March 2020 [2023-03-04].
- . Therapeutic Goods Administration (TGA). [2021-06-12].
- (PDF). Feb 2021.
- . Drugs.com. 2020-01-24 [2020-08-13].
- . Health Canada. 2014-10-23 [2023-03-10].
- . European Medicines Agency (EMA). 2018-09-17 [2020-04-02]. Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- . Union Register of medicinal products. [2023-03-03].
- . (emc). 2021-01-25 [2021-06-12].
- . (emc). 2021 -06-08 [2021-06-12].
- . (emc). 2021-05-25 [2021-06-12].
- . DailyMed. [2021-04-17].
- Feldmann M, Maini RN. . Nature Medicine. October 2003, 9 (10): 1245–1250. PMID 14520364. S2CID 52860838. doi:10.1038/nm939.
- .
- Peppel K, Crawford D, Beutler B. . The Journal of Experimental Medicine. December 1991, 174 (6): 1483–1489. PMC 2119031
 . PMID 1660525. doi:10.1084/jem.174.6.1483.
. PMID 1660525. doi:10.1084/jem.174.6.1483. - Peppel K, Poltorak A, Melhado I, Jirik F, Beutler B. . Journal of Immunology. November 1993, 151 (10): 5699–5703. PMID 7693816. S2CID 10859938. doi:10.4049/jimmunol.151.10.5699.
- U.S. Patent number: 5,447,851
- . [2008-01-10]. (原始内容存档于2007-10-20).
- Braun J, McHugh N, Singh A, Wajdula JS, Sato R. . Rheumatology. June 2007, 46 (6): 999–1004. PMID 17389658. doi:10.1093/rheumatology/kem069
 .
. - World Health Organization. . Geneva: World Health Organization. 2019. hdl:10665/325771
 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
. WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO. - (PDF) (Letter). Letter to Sally Gould. U.S. Food and Drug Administration (FDA). 1998-11-02 [2015-04-14].
- (PDF) (Letter). Letter to Sally Gould. U.S. Food and Drug Administration (FDA). 1999-05-27 [2015-04-14].
- (Letter). Letter to Sally Gould. U.S. Food and Drug Administration (FDA). 2002-01-15 [2015-04-14].
- (PDF) (Letter). Letter to Douglas Hunt. U.S. Food and Drug Administration (FDA). 2003-07-24 [2015-04-14].
- Maxwell LJ, Zochling J, Boonen A, Singh JA, Veras MM, Tanjong Ghogomu E, et al. . The Cochrane Database of Systematic Reviews. April 2015, 4 (4): CD005468. PMID 25887212. doi:10.1002/14651858.CD005468.pub2.
- (PDF) (Letter). Letter to Douglas Hunt. U.S. Food and Drug Administration (FDA). 2004-04-30 [2015-04-14].
- . Springer Select. 2012-10-31 [2018-11-17].
- US 8900583,Tobinick EL,「Methods for treatment of brain injury utilizing biologics」,发表于2014-12-02
- . Above the Law. 2017-02-24 [2022-06-27] (美国英语).
- (pdf). American Academy of Neurology. 2016-06-06.
- . [2008-05-02]. (原始内容存档于2008-05-05).
- (PDF). U.S. Food and Drug Administration (FDA): 13–14. [2013-12-20]. (原始内容 (PDF)存档于2015-09-24).
- Kim PJ, Lansang RP, Vender R. . Journal of Cutaneous Medicine and Surgery. July 2023, 27 (4): 358–367. PMC 10486173
 . PMID 37533141. doi:10.1177/12034754231188444.
. PMID 37533141. doi:10.1177/12034754231188444. - Zalevsky J, Secher T, Ezhevsky SA, Janot L, Steed PM, O'Brien C, et al. . Journal of Immunology. August 2007, 179 (3): 1872–1883. PMID 17641054. doi:10.4049/jimmunol.179.3.1872
 .
. - Madhusudan S, Muthuramalingam SR, Braybrooke JP, Wilner S, Kaur K, Han C, et al. . Journal of Clinical Oncology. September 2005, 23 (25): 5950–5959. PMID 16135466. doi:10.1200/JCO.2005.04.127.
- Smola MG, Soyer HP, Scharnagl E. . European Journal of Surgical Oncology. October 1991, 17 (5): 447–453. PMID 1936291.
- Houel S, Hilliard M, Yu YQ, McLoughlin N, Martin SM, Rudd PM, et al. . Analytical Chemistry. January 2014, 86 (1): 576–584. PMID 24308717. doi:10.1021/ac402726h.
- Mukai Y, Nakamura T, Yoshikawa M, Yoshioka Y, Tsunoda S, Nakagawa S, et al. . Science Signaling. November 2010, 3 (148): ra83. PMID 21081755. S2CID 24226117. doi:10.1126/scisignal.2000954.
- Lamanna WC, Mayer RE, Rupprechter A, Fuchs M, Higel F, Fritsch C, et al. . Scientific Reports. June 2017, 7 (1): 3951. Bibcode:2017NatSR...7.3951L. PMC 5479810
 . PMID 28638112. doi:10.1038/s41598-017-04320-5.
. PMID 28638112. doi:10.1038/s41598-017-04320-5. - Norman P. . Pharmaceutical Patent Analyst. January 2017, 6 (1): 5–7. PMID 28201948. doi:10.4155/ppa-2016-0043.
- Gardner J. . 2021-11-01.
- Kowalczyk L. . 2002-03-24.
- . U.S. Food and Drug Administration (FDA). 2016-04-01 [2020-06-04]. (原始内容存档于2017-01-18).
- "What's behind the whopping price tags on the newest generation of drugs: The story behind the production of Enbrel, Amgen's popular rheumatoid arthritis drug, provides insights as to why bioengineered drugs are so expensive." Carol M. Ostrom, Seattle Times, 2008-08-18
- Pollock A. . The New York Times. 2011-11-23 [2023-03-10].
- "Co-pay hike a painful reality; Miracle drug monthly cost jumps from $42 to $600" Archive.is的存檔,存档日期2013-01-18, Margery Eagan, Boston Herald, 2011-11-03
- (PDF). International Federation of Health Plans. [2017-11-24]. (原始内容 (PDF)存档于2017-10-22).
- . Sec.gov. [2019-06-05].
- . [2009-12-09]. (原始内容存档于2010-02-24).
- . 2011-11-25 [2019-07-14].
- Kaldre I. . www.law.duke.edu. 2008 [2019-06-05].
- Kaldre I. . www.law.duke.edu. 2008 [2019-06-05].
- . S&P Global Market Intelligence. 2013-04-18 [2023-12-28].
- . European Medicines Agency (EMA). 2018-09-17 [2020-04-02].
- . European Medicines Agency (EMA). 2018-09-17 [2 April 2020].
- (PDF). [2020-04-02].
- . European Medicines Agency (EMA). 2018-09-17 [2020-04-02].
- .
- . Therapeutic Goods Administration (TGA). 2021-02-25 [2021-06-12].