二氯卡宾
二氯卡賓(英语:dichloromethylidene,化學式)是一種有機化學中常見的活性中間體,屬於卡賓的一種[1]。二氯卡宾尚未被单独分离得到,但仍是有机化学中重要的活性中间体。二氯卡宾含有電中性的二价碳,其穩定性高於亞甲基卡賓、二溴卡賓等取代亚甲基卡賓,但不如碳正离子、自由基等活性中间体稳定[2]。
| 二氯卡宾 | |||
|---|---|---|---|
| |||
| IUPAC名 Dichloromethylidene | |||
| 别名 | 二氯化碳 氯化碳(II) 二氯甲烯 | ||
| 识别 | |||
| CAS号 | 1605-72-7 | ||
| PubChem | 6432145 | ||
| ChemSpider | 4937404 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | PFBUKDPBVNJDEW-UHFFFAOYAT | ||
| Beilstein | 1616279 | ||
| Gmelin | 200357 | ||
| ChEBI | 51370 | ||
| MeSH | Dichlorocarbene | ||
| 性质 | |||
| 化学式 | CCl2 | ||
| 摩尔质量 | 82.92 g·mol−1 | ||
| 危险性 | |||
| 主要危害 | 反應性極高 | ||
| 相关物质 | |||
| 相关化学品 | 二聚体C2Cl4 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
製備
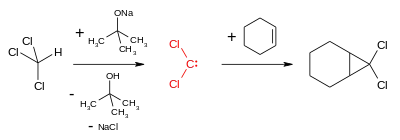
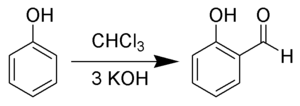
二氯卡賓通常由氯仿和鹼(如氫氧化鈉、氫氧化鉀和叔丁醇鉀)的α-消除反應製備而成。具体機理為,多卤代烷如氯仿中的氫被鹼奪取,形成負離子,負離子再失去氯離子而形成二氯卡賓[3][4][5]。

相轉移催化劑可以促進這個反應,如在苄基三乙基溴化銨的作用下,氯仿和鹼在水相-有機相界面反應,然后有機相中的负离子被季铵盐正离子解脱,并在有機相分解成二氯卡賓与氯代四级铵。[6]生成的卡賓可立即在有機相中與有機化合物反應。
二氯卡宾也可以通过三氯乙酸制备[7]。機理為三氯乙酸脫去質子,生成三氯乙酸根負離子,在加熱條件下可以脫羧,再失去氯離子,生成二氯卡賓。
3,3-二氯双吖丙啶(dichlorodiazirine)在黑暗中稳定,光解生成二氯卡賓和氮氣[9],可以由苯酚制备:
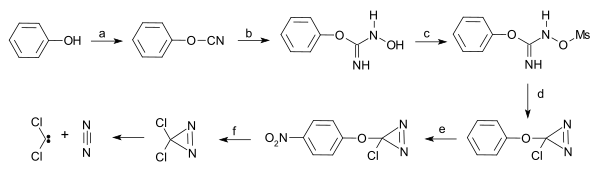 Dichlorocarbene from dichlorodiazirine |
| 由3,3-二氯双吖丙啶製備二氯卡賓[註 1] |
|---|
反應
历史
二氯卡宾在1862年就被作为一种活性中间体由Anton Geuther发现,他将氯仿的结构认为是CCl2.HCl[16]。在1950年,Jack Hine在研究四氯化碳碱性水解的过程中重新研究了二氯卡宾[17]。威廉·冯·艾格斯多林在1954年报告了由氯仿制备二氯卡宾的过程及其在合成中的应用。[18]
參見
- 卡賓
- 活性中间体
注釋
參考資料
- . PubChem. [2021-08-07]. (原始内容存档于2021-10-28).
Dichlorocarbene is a carbene.
- 邢其毅; 裴堅; 裴偉偉; 徐瑞秋. . 第四版. 北京大學出版社. : 353. ISBN 9787301272121 (中文).
- Srebnik, M.; Laloë, E. "Chloroform" Encyclopedia of Reagents for Organic Synthesis" 2001 John Wiley.doi:10.1002/047084289X.rc105
- (1988) "1,6-Methano[10]annulene". Org. Synth.; Coll. Vol. 6: 731.
- Gokel, G. W.; Widera, R. P.; Weber, W. P. (1988). "Phase-Transfer Hofmann Carbylamine Reaction: tert-Butyl Isocyanide". Org. Synth.; Coll. Vol. 6: 232.
- 邢其毅; 裴堅; 裴偉偉; 徐瑞秋. . 第四版. 北京大學出版社. : 673. ISBN 9787301279434 (中文).
- . Organic Syntheses. 1974, 54: 11. doi:10.15227/orgsyn.054.0011.
- . Organic Syntheses. 1966, 46: 98. doi:10.15227/orgsyn.046.0098.
- Gaosheng Chu, Robert A. Moss, Ronald R. Sauers. . J. Am. Chem. Soc. 2005, 127 (41): 14206–14207. PMID 16218614. doi:10.1021/ja055656c.
- A Facile Procedure for the Generation of Dichlorocarbene from the Reaction of Carbon Tetrachloride and Magnesium using Ultrasonic Irradiation Haixia Lin, Mingfa Yang, Peigang Huang and Weiguo Cao Molecules 2003, 8, 608-613 Online Article (页面存档备份,存于)
- Marvel, C. S.; Sperry, W. M. . Organic Syntheses. 1928, 8: 26. doi:10.15227/orgsyn.008.0026.
- Pond, F. J.; O. P., Maxwell; G. M., Norman. . Journal of the American Chemical Society. 1899, 22 (11): 955–967 [2021-08-09]. doi:10.1021/ja02061a002. (原始内容存档于2021-08-09).
- Lars Skattebøl. . J. Org. Chem. 1966, 31 (9): 2789–2794. doi:10.1021/jo01347a014.
- Wynberg, Hans. . Chemical Reviews. 1960, 60 (2): 169–184. doi:10.1021/cr60204a003.
- Gokel, G.W.; Widera, R.P.; Weber, W.P. . Organic Syntheses. 1988, 55: 232. doi:10.15227/orgsyn.055.0096.
- Ueber die Zersetzung des Chloroforms durch alkoholische Kalilösung Annalen der Chemie und Pharmacie Volume 123, Issue 1, Date: 1862, Pages: 121-122 A. Geuther doi:10.1002/jlac.18621230109
- Carbon Dichloride as an Intermediate in the Basic Hydrolysis of Chloroform. A Mechanism for Substitution Reactions at a Saturated Carbon Atom Jack Hine J. Am. Chem. Soc., 1950, 72 (6), pp 2438–2445 doi:10.1021/ja01162a024
- The Addition of Dichlorocarbene to Olefins W. von E. Doering and A. Kentaro Hoffmann J. Am. Chem. Soc.; 1954; 76(23) pp 6162 - 6165; doi:10.1021/ja01652a087
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.