氮氣
氮氣是氮的單質形式,化學式為N2。
| 氮氣 | |
|---|---|
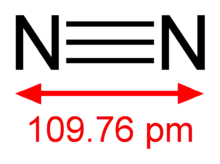 | |
 | |
| IUPAC名 Dinitrogen(二氮) | |
| 别名 | Diatomic nitrogen(二原子氮) |
| 识别 | |
| CAS号 | 7727-37-9 |
| SMILES |
|
| 性质 | |
| 化学式 | N2 |
| 摩尔质量 | 28.01 g·mol−1 |
| 相关物质 | |
| 相关化学品 | 三线态氧 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氮氣是地球大氣中所佔比例最高的氣體,佔有78.3%(其次為氧氣的20.99%)。
一般而言,氮氣不可燃亦不可助燃,但是对于镁来说,它可以助燃。
制备
- 工業法:液態空氣分餾,沸點低於先汽化,但無法得純。也可以通过机械方法(例如加压反渗透膜和变压吸附法)处理氣態空气得到氮气。商品化氮气常常是制作工业用氧气时的副产品。工业氮气被压缩后都用黑色钢瓶装,常被稱为OFN(oxygen-free nitrogen,无氧氮气)。[1]
- 實驗法:
2.純空氣通過灼熱銅粉或銅絲網去氧:
- (純度低)
3.氨氣通過灼熱氧化銅:
氮氣的用途
廉价又安定的保护气,用于金属炼制及高温合成时的简单保护性氛围(但其稳定性不及氦气及氩气);高温下用于合成氮化物(如氮化硅陶瓷、氮化硼等)。其化合物亦有用於農業,如氮肥。液態氮有時用於冷卻。此外,氮氣是包装食品的填充氣體,用于保持包装外形避免挤压损坏,同时更重要的,隔绝氧气而使食物不變壞。
氮氣在生命形成的保護中起重要意義,氮氣化學性質穩定,不像其他氣體太活躍容易破壞生物結構,但又在大氣中起到阻擋太空粒子及隕石沖擊作用,而其分子重量,與氧氣相約且比氧氣輕,不會使氧氣被排到太高的空中或太過聚集於地球表面。而且其溫室效應不明顯,不會使地球表面溫度太高。因此給生物提供了一個適合生長和進化的穩定環境。
可以利用氮氣在鐵催化劑存在之下與氫氣反應,生成氨。這叫做哈柏法。
参考资料
- Reich, Murray.; Kapenekas, Harry. . Industrial & Engineering Chemistry. 1957, 49 (5): 869–873. doi:10.1021/ie50569a032.
- Bartlett, J. Kenneth. . Journal of Chemical Education (American Chemical Society (ACS)). 1967, 44 (8): 475. ISSN 0021-9584. doi:10.1021/ed044p475.
- Eremets, M. I.; Popov, M. Yu.; Trojan, I. A.; Denisov, V. N.; Boehler, R.; Hemley, R. J. . The Journal of Chemical Physics (AIP Publishing). 2004-06-08, 120 (22): 10618–10623. ISSN 0021-9606. doi:10.1063/1.1718250.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.